→SO3→+H2O→H2SO4
空気の蒸留
→3Cu(NO3)2+4H2O+2NO
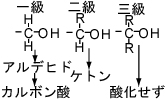
脱水作用、酸化作用
Cs青Ca橙Sr紅Ba黄緑
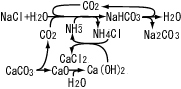
Ca(OH)2+CO2→CaCO3
CaCO3+CO2+H2O→Ca(HCO3)2
→2Al3++3H2O
Al2O3+2OH−+3H2O
→2[Al(OH)4]−
→2Al3++3H2
2Al+2OH−+6H2O→
2[Al(OH)4]−
→H2S:Cu2+、Cd2+、Pb2+
→HNO3+NH3過剰:Fe3+、Al3+、Cr3+
⇔Cr2O72−(赤)+OH−
Cr2O72−+14H++6e−
→2Cr3+(緑)+7H2O
→CO32−Ca2+、Ba2+
→炎色反応
+Na→C-ONa
酸化
脱水
エステル化
付加反応:C≡C+X2→X-C=C-X
付加反応:C=C+X2→X-C-C-X
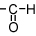 を持つもの
を持つもの還元性→フェーリング反応、銀鏡反応
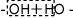 →-O-(エーテル)
→-O-(エーテル)170℃:
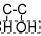 →C=C(アルケン)
→C=C(アルケン)