化合物:二種類以上の原子からなる物質
通常原子が結合したもの。
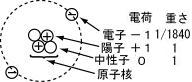
原子:分子を構成する粒
原子の重さを表す
原子番号:陽子数,原子の種類を表す
表し方:
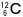
構造が異なるもの
C:黒鉛,ダイヤモンド、O:酸素,オゾン
P:黄リン,赤リン
S:単斜硫黄,斜方硫黄,ゴム状硫黄
| H | He | ||||||
| Li | Be | B | C | N | O | F | Ne |
| Na | Mg | Al | Si | P | S | Cl | Ar |
| K | Ca |
エネルギー
得たりしたもの。
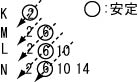
Al3+
Cu+(Cu2+もある)
左端から二番目:2+
右端から三番目:2−
右端から二番目:−
窒素酸素フッ素ネオンナトリウム
マグネシウムアルミニウムケイ素リン
硫黄塩素アルゴンカリウム
カルシウム
→分子量決定(分子式)
→性質測定(構造式)
6.02×1023個
(原子量、分子量)g
0℃、1atmの気体で22.4L
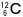 を12とした時の
を12とした時の原子、分子、化学式の重さ
原子の性質に関係
=反応したモル比
強い結合
安定。
不対電子:電子がペアになっていないもの。不安定。
希ガスを除く右上の方が大
柔軟性あり。物体の変形可、
電気や熱を通す。
左から二列目、+2価になる
右から二列目、−2価になる
右端列、単原子で安定